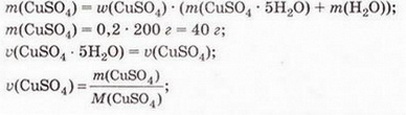ЗНАЧЕННЯ РОЗЧИНІВ У ПРИРОДІ ТА ЖИТТІ ЛЮДИНИ. ПОНЯТТЯ ПРО ДИСПЕРСНІ СИСТЕМИ, КОЛОЇДНІ ТА ІСТИННІ РОЗЧИНИ. НАСИЧЕНІ Й НЕНАСИЧЕНІ РОЗЧИНИ
Поняття про дисперсні системи.
На шляху до успіху пригадаємо з вивчених курсів
природознавства,
хімії,
фізики:
що таке
дисперсія світла; чим відрізняються
однорідні й неоднорідні суміші, у які способи їх розділяють; що таке
молекули, як вони рухаються; чим зумовлене явище
дифузії; які особливості твердого, рідкого та газува-того стану речовин; чим відрізняються молекулярні та йонні кристали; які ознаки притаманні системі; де трапляються
розчини у природі й побуті; шукатимемо відповіді на запитання:
де трапляються дисперсні системи? Що таке дисперсний стан матерії? З чого складаються дисперсні системи? У які способи їх класифікують? Де використовують знання про дисперсні системи?
• Дисперсні системи - світ, у якому ми живемо. Чи обґрунтоване це тзердження? Більша частина речовини Всесвіту перебуває у вигляді пилу. Космічний простір, гідросфера й атмосфера, земна кора та надра, ґрунти, живі організми, харчові продукти, лікарські препарати та інші ужиткові предмети містять речовини у роздрібненому, тобто гисперсному, стані. Отже, дисперсний стан є основним станом матерії.
Склад дисперсної системи схематично зображено на малюнку 3.1.

Усім дисперсним системам притаманні дві фундаментальні фізико-хімічні ознаки - гетерогенність (наявність поверхні розподілу між фазами) і дисперсність (роздрібненість). Дисперсність характеризують розміром частинок дисперсної фази. Як за ступенем дисперсності класифікують системи з кількох речовин, легко зрозуміти з малюнка 3.2.
 • Приклади дисперсних систем
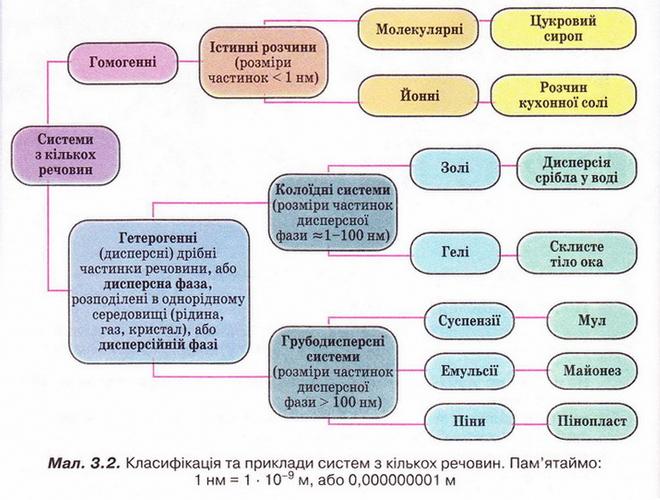
• Приклади дисперсних систем, класифікованих за агрегатним станом дисперсної та дисперсійної фаз, наведено у таблиці 3.1.
Таблиця 3.1 Дисперсні системи.
Перелік дисперсних систем безмежний: мінерали та сплави, пінобетон і нафта, косметичне молочко та гель для волосся, крем для взуття й мармелад, папір і квасна піна, хліб і вершкове масло, смог, тверде ракетне паливо й лакофарбові матеріали.
Завдання
Спираючись на повсякденний досвід та знання з інших природничих дисциплін, наведіть кілька прикладів дисперсних систем.
Після зіставлення інформації, наведеної на малюнку 3.2 і в таблиці 3.1, можна дійти певних висновків щодо визначень найважливіших дисперсних систем.
• Суспензії - зависі твердих частинок у рідкому середовищі. Тобто це грубодисперсні системи, в яких дисперсною фазою є тверда речовина, а дисперсійною - рідина, у якій тверда речовина практично не розчиняється. Наприклад, аби виготовити водну суспензію глини, її подрібнюють на тонкий порошок, висипають у воду та ретельно перемішують. З повсякденного досвіду ви, напевно, знаєте, що поступово частинки глини під дією сили земного тяжіння осядуть на дно посудини. Це зумовлено тим, що частинки суспензій не виявляють броунівського руху. Процес сідання триватиме тим довше, чим дрібніші частинки дисперсної фази.
Частинки дисперсної фази, густина яких більша за густину дисперсійної гази, утворюють осад. Якщо ж їхня густина менша - вони спливають на п: верхню. Частинки твердих речовин, які не змочуються водою, також спливають вгору. Прикладом такої речовини є сірка, густина якої більша за густину води.
У природних умовах суспензії утворюються внаслідок розмивання ґрунтів І сою, забруднення водойм атмосферним пилом. Суспензією є й пульпа - суміш тонкоподрібненої корисної копалини з водою. Пульпа утворюється під час здрібнювання руд перед збагаченням. Бурові промивні рідини, фарби, будівельні розчини - також суспензії. У вигляді суспензій застосовують деякі добрива й отрутохімікати, чимало пекарських препаратів.
• Емульсії — дисперсні системи, в яких і дисперсна, й дисперсійна фази — рідини, що не змішуються.
Виготовити емульсію можна, наприклад, тривалим збовтуванням суміші води та олії (мал. 3.3,1). Однак згодом вона розшарується (мал. 3.3,2).
 Завдання
Поясніть, чому в інструкціях до лікарських препаратів у формі суспензій та емульсій завжди є вказівка: «Перед вживанням ретельно збовтати».
Завдання
Поясніть, чому в інструкціях до лікарських препаратів у формі суспензій та емульсій завжди є вказівка: «Перед вживанням ретельно збовтати».
Чимало косметичних засобів, лікарських препаратів - емульсії. Емульсії використовують на виробництві підчас шліфування, свердління та різання металів, пластмас, кераміки тощо. У вигляді емульсій застосовують засоби боротьби з бур'янами та шкідниками сільськогосподарських культур.
Суспензії та емульсії - двохфазні системи. Двохфазними системами також є піни.
Завдання
Спробуйте за аналогією до наведених визначень суспензій і емульсій сформулювати визначення піни як дисперсної системи. Наведіть кілька прикладів пін, відомих вам з повсякденного життя.
Грубодисперсні системи (суспензії, емульсії, рідкі піни) нестійкі і згодом руйнуються: суспензії та піни осідають, емульсії розшаровуються. Аби зберегти споживчі властивості товарів, які містять грубодисперсні системи, до їхнього складу вводять різноманітні емульгатори та стабілізатори піни. Природні емульгатори, наприклад яєчний білок і жовток, традиційно використовують у харчових продуктах. Нині до складу маргарину, морозива, збитих вершків, майонезу тощо входять й інші емульгатори та стабілізатори піни.
Завдання
Пригадайте, що таке Е-числа. Дізнайтеся, якими Е-числами позначають емульгатори.
Аналізуючи зміст таблиці 3.1, ви, напевно, звернули увагу, що система газ-газ не є дисперсною. Адже зазвичай під час змішування гази утворюють істинні розчини (винятком є гази за високого тиску та низьких температур).
• Розчин - однофазна гомогенна система, яка складається з двох або більше компонентів. Розчин може перебувати у будь-якому агрегатному стані. З попередніх курсів природничих наук вам добре відомі рідкі розчини.
Завдання
Наведіть кілька прикладів рідких розчинів, які широко використовують у повсякденному житті.
Утім існують і тверді розчини. До них належить чимало сплавів і мінералів (мал. 3.4).

Газуваті розчини зазвичай називають газовими сумішами. Аквалангісти для дихання під водою використовують газову суміш «АКС» (англійською «Nitгох»).
Завдання
Пригадайте склад найвідомішої та найважливішої для людини газової суміші й сучасні українські назви
хімічних елементів і відповідних простих речовин. Розшифруйте абревіатури «Nitгох» та «АКС», якщо літерою «С» позначено слово «суміш».
З вивчених курсів природничих наук ви вже маєте певні уявлення про розчинність речовин і складові розчину. Ці та інші якісні й кількісні характеристики істинних розчинів заслуговують на особливу увагу. Тому докладніше про них ви дізнаєтеся з наступних параграфів.
• Колоїдні системи за розміром частинок посідають проміжне місце між істинними розчинами і грубодисперсними системами. Аби пересвідчитися у цьому, поверніться до схеми 3.1. Назва високодисперсних систем, у яких розміри частинок дисперсної фази знаходяться у межах від 1 до 100 нм, походить від грецьких слів коllа - клей (kollodes - клейкий) і еіdоs - вигляд.
Золі — високодисперсні системи, дисперсна фаза яких перебуває у твердому агрегатному стані. Золі поширеніші за істинні розчини. Цитоплазма живих клітин, кров, соки рослин - складні золі. Чинбарство, фарбування, виробництво штучних волокон, виготовлення клеїв, лаків, плівок, чорнила пов'язані з використанням цих дисперсних систем. Золі ґрунтів забезпечують їхню родючість. Добування й застосування водних золів золота описано у китайських книгах з медицини (І ст. до н. е.), наукових працях Парацельса. Препарати на основі золів срібла, золота, платини використовують у медицині як дезінфікуючі засоби та маркери (визначники) небезпечних хвороб.
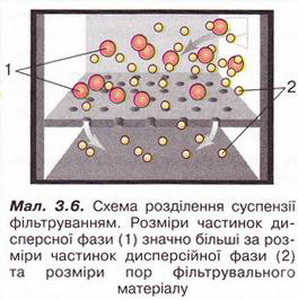
Аналізуючи зміст таблиці 3.1, ви дізналися, що дисперсійна фаза золів може бути твердою. Однак найчастіше золями називають системи із рідкою дисперсійною фазою. Це так звані колоїдні розчини. Вони містять частинки твердої речовини (міцели), які перебувають у броунівському русі. Саме він перешкоджає осіданню частинок дисперсної фази під дією сили тяжіння і є однією з причин стійкості колоїдних розчинів. Якщо золі й відстоюються, то дуже повільно (інколи за кілька років). Частинки дисперсної фази колоїдних розчинів неможливо відокремити від дисперсійної фази фільтруванням. За допомогою звичайних центрифуг також практично неможливо розділити колоїдний розчин на його складові. Подекуди це вдається зробити із використанням центрифуг з дуже великою швидкістю обертання - так званих ультрацентрифуг.
Така стійкість колоїдних розчинів зумовлена не лише малими розмірами частинок дисперсної фази. Міцели - утворення з мікрокристалів, йонів і молекул. На поверхні міцел відбуваються досить складні явища електричної природи, тому колоїдні частинки відштовхуються одна від одної. Для осадження золю (мал. 3.5,1) необхідно, щоб його частинки сполучилися у більші за розміром. Таке сполучення називають коагуляцією, а осадження під впливом сили тяжіння - седиментацією (мал. 3.5,2).
 Завдання
Роздивіться малюнок 3.6. Поміркуйте й висловіть припущення, чому частинки дисперсної фази колоїдних розчинів на відміну від грубодисперсних систем! не затримуються паперовим фільтром.
Завдання
Роздивіться малюнок 3.6. Поміркуйте й висловіть припущення, чому частинки дисперсної фази колоїдних розчинів на відміну від грубодисперсних систем! не затримуються паперовим фільтром.
 • Гель-
• Гель- структурована дисперсна система, яка за певних умов може утворитися із золю. Мармеладні драглі – продукт перетворення золю пектину на гель. У гелі вся маса колоїдних частинок зв’язує розчинник, і система переходить у специфічний напіврідкий-напівтвердий стан. Гелі виявляють деякі властивості твердих тіл: міцність, пружність, пластичність, здатність зберігати форму. Це зумовлено існуванням у гелях структурної сітки, утвореної частинками дисперсної фази. Вони з’єднанні в місцях контакту силами міжмолекулярної взаємодії. В комірках структурної сітки міститься дисперсійна фаза гелю. Унаслідок випаровування рідка дисперсійна фаза може заміщуватися газуватою. Наприклад, обережним нагріванням гелю силікатної кислоти одержують силікагель. Він має дуже пористу структуру з безліччю капілярів і пор, тож добре вбирає вологу, сторонні запахи, тощо. Силікагель добре відомий вам з повсякденного життя – пакетики з цією речовиною-осушувачем вкладають у коробки з побутовою технікою, взуттям, його використовують у складі наповнювачів туалетів для домашніх улюбленців.
Завдання
Наведіть приклади гелів, які відомі вам з повсякденного життя.
Можливий також обернений процес переходу гелю у золь. Колоїдні системи грунтів переважно є гелями. Однак унаслідок механічного впливу (вібрації, струшування, перемішування) гель може перейти в золь і грунт самочинно зсуватиметься схилом.
Завдання
Будівництво багатоповерхівок потребує забивання паль. Оцініть доцільність висотної забудови схилів Дніпра у Києві.
• Які ще особливості притаманні колоїдним розчинам? Як практично відрізнити колоїдний розчин віл істинного? На відміну від істинних розчинів для золів характерний ефект Тіндаля. Його вияви ви неодноразово спостерігали у повсякденному житті (мал. 3.7).

Ефект Тіндаля виникає під час проходження крізь золь пучка світла (наприклад, від звичайної лазерної указки). Промінь світла розсіюється, проходячи через золь, таким чином, що його шлях стає видими (мал. 3.8). Явище зумовлене тим, що розміри частинок дисперсної фази золю достатньо великі, аби розсіювати світло.
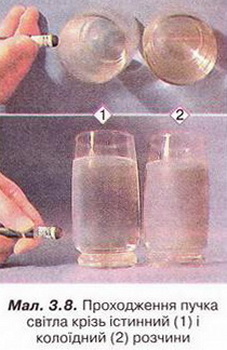
На ефекті Тіндаля базуються широко застосовані у наукових дослідженнях і на виробництві методи виявлення, визначеня розміру й концентрації колоїдних частинок. Наприклад, ультрамікроскопію використовують для дослідження дисперсних систем, контролю чистоти атмосферного повітря, води, ступеня забруднення оптично прозорих середовищ сторонніми включеннями. Оптичний димовий сигналізатор визначає на ранній стадії як приховані, так і відкриті пожежі з виділенням диму. Принцип дії цього приладу також ґрунтується на ефекті Тіндаля.
Завдання
Поміркуйте й висловіть припущення, як саме працює оптичний димовий сигналізатор. Спробуйте пояснити, чи можна цей прилад використовувати у дуже запилених приміщеннях.
Стисло про головне
Основний стан, у якому перебуває матерія, - дисперсний. Фаза - однорідна частина неоднорідної фізико-хімічної системи. У формі дрібних частинок дисперсна фаза розподілена у дисперсійній фазі.
Усім дисперсним системам притаманні гетерогенність (наявність поверхні розподілу між фазами) і дисперсність (роздрібненість).
За розміром частинок системи з кількох речовин класифікують на гомогенні та гетерогенні.
Також дисперсні системи класифікують за агрегатним станом дисперсної та дисперсійної фаз.
Суспензії - дисперсні системи, в яких дисперсною фазою є тверда речовина, а дисперсійною - рідина, у якій тверда речовина практично не розчиняється.
Частинки суспензій не виявляють броунівського руху. Мул, персиковий сік з м'якоттю, суміш глини з водою - суспензії.
Емульсії - дисперсні системи, в яких і дисперсна, і дисперсійна фази - рідини, які не змішуються. Вершкове масло, молоко, майонез, косметичне молочко - емульсії.
Піни - дисперсні системи, в яких дисперсною фазою є газ, а дисперсійною - рідина або тверда речовина.
Система газ-газ не є дисперсною, під час змішування гази утворюють істинні розчини.
Розчин - однофазна гомогенна система, яка складається з двох або більше компонентів. Розчин може перебувати у будь-якому агрегатному стані. Столовий оцет, цукровий сироп, сплав золота зі сріблом, азото-киснева суміш - істинні розчини.
Колоїдні системи за розміром частинок посідають проміжне місце між істинними розчинами і грубодисперсними системами.
Золі - високодисперсні системи, дисперсна фаза яких перебуває у твердому агрегатному стані. Кольорові стекла, дисперговані у воді золото, срібло, мідь - золі, так само, як і тютюновий дим.
Колоїдні розчини - золі з рідкою дисперсійною фазою. Міцели - утворення з мікрокристалів, йонів і молекул - становлять дисперсну фазу золів. Причини стійкості колоїдних розчинів - броунівський рух міцел та електричні явища на поверхні цих частинок. їх неможливо відокремити від дисперсійної фази ані фільтруванням, ані центрифугуванням. Під час осадження золю його частинки сполучаються у більші за розміром. Таке сполучання називають коагуляцією, а осадження під впливом сили тяжіння - седиментацією.
Гель - структурована дисперсна система, яка за певних умов може утворитися із золю. Можливий і обернений процес переходу гелю у золь. Мармелад, желе, силікагель, кисіль - гелі.
Колоїдним розчинам, на відміну від істинних, властивий ефект Тіндаля.
Скарбничка досвіду
1. Використовуючи лазерну указку, дослідіть, істинними розчинами чи колоїдними системами є: рідкий кисіль, мінеральна вода, столовий оцет, газована вода, фруктовий сік, солодкі газовані напої тощо. За результатами дослідження підготуйте презентацію.
2. Дізнайтеся: а) який препарат називають «шумерським сріблом» та для чого його використовують; б) що таке нанодисперсії, де їх застосовують. За результатами дослідження підготуйте презентацію.
Насичені й ненасичені розчини
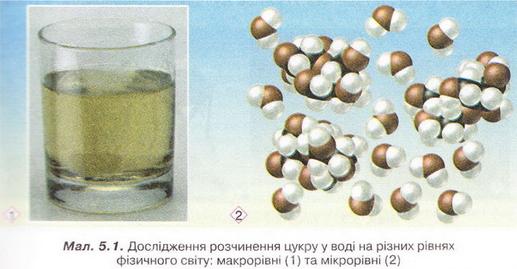
• Насичені й ненасичені розчини. Вивчаючи попередній параграф, ви, звичайно, звернули увагу, що за умови контакту води з достатньо великою кількістю кристалів розчинюваної речовини число структурних частинок, які відокремлюються від кристала й приєднуються до нього, стає однаковим. Тобто хоча на мікрорівні взаємозворотні процеси розчинення й кристалізації тривають, на мікрорівні спостерігаємо припинення розчинення (мал. 6.5).
 • Розчин насичений, якщо у ньому за певної температури і тиску розчинювана речовина перебуває у рівновазі з розчином.
• Розчин насичений, якщо у ньому за певної температури і тиску розчинювана речовина перебуває у рівновазі з розчином.
Якщо за тих самих умов відокремити насичений розчин від надлишку розчинюваної речовини, він залишиться насиченим, хоча вже й не перебуватиме в рівновазі з розчиненою речовиною.
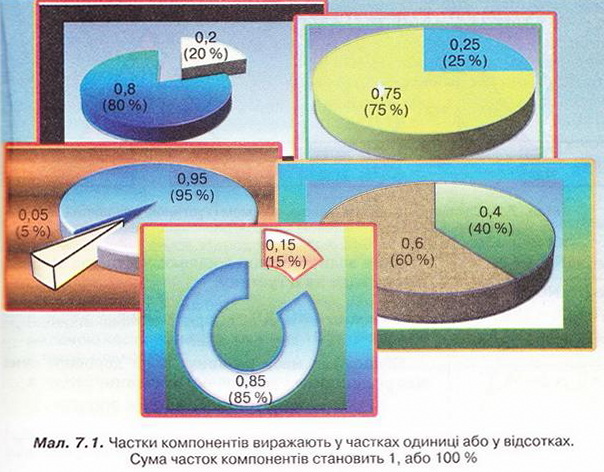
Добавляння до насиченого розчину води порушує рівновагу в ньому – починає переважати процес розчинення і розчин стає ненасиченим. Надлишок розчинюваної речовини - достатня умова насиченості розчину.
Саме з насичених розчинів вирощують чудові кристали (мал. 6.6). У природі трапляються і насичені, й ненасичені розчини. Наприклад, столові мінеральні води - ненасичені розчини. А ропа лиманів - насичений розчин солей.

Існують і пересичені розчини. Їх зазвичай одержують під час повільного охолодження насичених розчинів. Пересичені розчини - нестійкі системи. Найменше струшування порушує рівновагу в них - відбуватиметься миттєва кристалізація. Наприклад, внесення в пересичений розчин натрій ацетату кристалика цієї солі або струшування зумовлює швидку кристалізацію, яка супроводжується виділенням великої кількості теплоти. Цю властивість пересиченого розчину натрій ацетату використовують у так званих сольових грілках.
Завдання
Кристалізація пересиченого розчину натрій ацетату супроводжується виділенням великої кількості теплоти. Яка енергія, на вашу думку, більша: та, що витрачається на відщеплення молекул води від гідратованих йонів, чи та, що виділяється під час сполучання цих йонів у кристалічні ґратки натрій ацетату? Аби правильно відповісти на це запитання, пригадайте: а) який процес є оберненим до процесу розчинення; б) чим зумовлені теплові ефекти під час розчинення.
Розрізняють концентровані й розбаввлені розчини. Концентровані розчини містять набагато більше розчинюваної речовини, ніж розчинника, а розбавлені - навпаки. Води Мертвого моря - дуже концентрований розчин солей (мал. 6.7).

Оцтова есенція - концентрований водний розчин оцтової кислоти. А столовий оцет - її розбавлений розчин.
Утім, концентрований розчин може бути ненасиченим. Наприклад, за 20
0С у воді масою 100 г можна розчинити цукор масою 150 г. Утворений розчин дуже концентрований, проте ненасичений, бо за цієї ж температури в ньому ще можна розчини цукор масою 53 г.
Стисло про головне
Розчинність - максимальна маса речовини, яка може за певних умов (температури, тиску) розчинитися в розчиннику масою 100 г.
Розчинність залежить від природи розчинюваної речовини і розчинника, температури й (для газуватих речовин) тиску.
Деякі речовини необмежено розчиняються у воді. Розрізняють добре розчинні, малорозчинні та практично нерозчинні у воді речовини. Абсолютно нерозчинних речовин не існує.
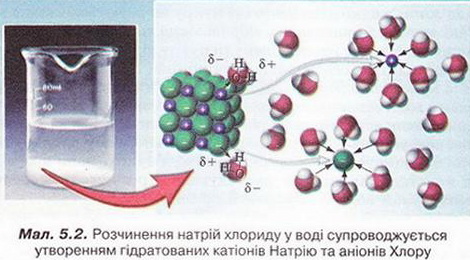
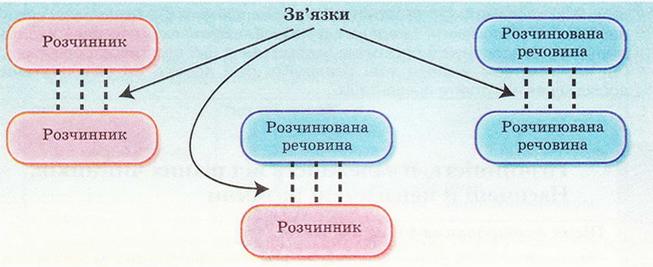
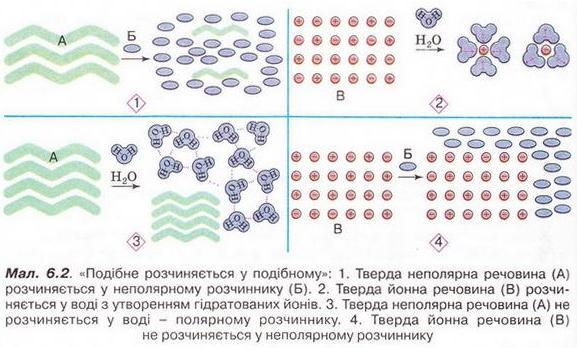
Під час утворення розчину зв'язки між частинками кожного з його компонентів замінюються на зв'язки між частинками різних компонентів. Аби нові зв'язки могли утворюватися, компоненти розчину повинні мати однотипні зв'язки, тобто бути однієї природи.
Розчинність твердих речовин з підвищенням температури здебільшого зростає. Розчинність газів залежить не лише від температури, а й від тиску. Зі зменшенням тиску розчинність газів зменшується.
На відміну від більшості твердих речовин, розчинність газів зі зростанням температури зменшується.
Розчин є насиченим, якщо в ньому за певної температури і тиску розчинювана речовина перебуває в рівновазі з розчином. Добавляння до насиченого розчину води порушує рівновагу в ньому - починає переважати процес розчинення і розчин стає ненасиченим. Надлишок розчинюваної речовини - достатня умова насиченості розчину за певної температури.
Існують і пересичені розчини. їх зазвичай одержують під час повільного охолодження насичених розчинів. Пересичені розчини - нестійкі системи. Найменше струшування порушує рівновагу в них - відбувається миттєва кристалізація. Тепловий ефект під час кристалізації пересичених розчинів деяких сполук використовують у так званих сольових грілках.
Розрізняють концентровані й розбавлені розчини. Концентровані розчини містять набагато більше розчинюваної речовини, ніж розчинника, а розбавлені - навпаки. Концентрований розчин добре розчинної речовини може бути ненасиченим, а розбавлений розчин малорозчинної сполуки - насиченим.